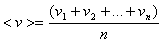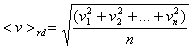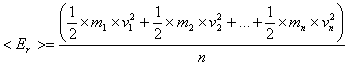Цель молекулярно-кинетической теории состоит в том, чтобы истолковать те свойства тел, которые непосредственно наблюдаются на опыте (давление и температура, например), как суммарный результат действия молекул.
Остановимся на некоторых статистических характеристиках движения молекул газа. Сюда, в первую очередь, относятся средняя арифметическая и средняя квадратичная скорости молекул газа. Рассмотрим n молекул газа с массами m1, m2,...mn, обладающих в некоторой инерциальной системе отсчета мгновенными скоростями v1, v2, ..., vn, соответственно.
Средняя скорость молекул газа-это сумма величин (модулей) скоростей всех молекул газа, деленная на их общее число